Primero, la estructura y propiedades del cristal de SiC.
El SiC es un compuesto binario formado por el elemento Si y el elemento C en una proporción 1:1, es decir, 50% silicio (Si) y 50% carbono (C), y su unidad estructural básica es el tetraedro SI-C.
Diagrama esquemático de la estructura del tetraedro de carburo de silicio.
Por ejemplo, los átomos de Si tienen un diámetro grande, equivalente a una manzana, y los átomos de C tienen un diámetro pequeño, equivalente a una naranja, y se apilan un número igual de naranjas y manzanas para formar un cristal de SiC.
SiC es un compuesto binario, en el que el espacio entre los átomos del enlace Si-Si es de 3,89 A, ¿cómo entender este espacio? En la actualidad, la máquina de litografía más excelente del mercado tiene una precisión de litografía de 3 nm, que es una distancia de 30 A, y la precisión de la litografía es 8 veces mayor que la de la distancia atómica.
La energía del enlace Si-Si es 310 kJ/mol, por lo que puedes entender que la energía del enlace es la fuerza que separa estos dos átomos, y cuanto mayor es la energía del enlace, mayor es la fuerza que necesitas para separar.
Por ejemplo, los átomos de Si tienen un diámetro grande, equivalente a una manzana, y los átomos de C tienen un diámetro pequeño, equivalente a una naranja, y se apilan un número igual de naranjas y manzanas para formar un cristal de SiC.
SiC es un compuesto binario, en el que el espacio entre los átomos del enlace Si-Si es de 3,89 A, ¿cómo entender este espacio? En la actualidad, la máquina de litografía más excelente del mercado tiene una precisión de litografía de 3 nm, que es una distancia de 30 A, y la precisión de la litografía es 8 veces mayor que la de la distancia atómica.
La energía del enlace Si-Si es 310 kJ/mol, por lo que puedes entender que la energía del enlace es la fuerza que separa estos dos átomos, y cuanto mayor es la energía del enlace, mayor es la fuerza que necesitas para separar.
Diagrama esquemático de la estructura del tetraedro de carburo de silicio.
Por ejemplo, los átomos de Si tienen un diámetro grande, equivalente a una manzana, y los átomos de C tienen un diámetro pequeño, equivalente a una naranja, y se apilan un número igual de naranjas y manzanas para formar un cristal de SiC.
SiC es un compuesto binario, en el que el espacio entre los átomos del enlace Si-Si es de 3,89 A, ¿cómo entender este espacio? En la actualidad, la máquina de litografía más excelente del mercado tiene una precisión de litografía de 3 nm, que es una distancia de 30 A, y la precisión de la litografía es 8 veces mayor que la de la distancia atómica.
La energía del enlace Si-Si es 310 kJ/mol, por lo que puedes entender que la energía del enlace es la fuerza que separa estos dos átomos, y cuanto mayor es la energía del enlace, mayor es la fuerza que necesitas para separar.
Por ejemplo, los átomos de Si tienen un diámetro grande, equivalente a una manzana, y los átomos de C tienen un diámetro pequeño, equivalente a una naranja, y se apilan un número igual de naranjas y manzanas para formar un cristal de SiC.
SiC es un compuesto binario, en el que el espacio entre los átomos del enlace Si-Si es de 3,89 A, ¿cómo entender este espacio? En la actualidad, la máquina de litografía más excelente del mercado tiene una precisión de litografía de 3 nm, que es una distancia de 30 A, y la precisión de la litografía es 8 veces mayor que la de la distancia atómica.
La energía del enlace Si-Si es 310 kJ/mol, por lo que puedes entender que la energía del enlace es la fuerza que separa estos dos átomos, y cuanto mayor es la energía del enlace, mayor es la fuerza que necesitas para separar.
Sabemos que toda sustancia está formada por átomos y que la estructura de un cristal es una disposición regular de los átomos, lo que se denomina orden de largo alcance, como se muestra a continuación. La unidad cristalina más pequeña se llama celda, si la celda es una estructura cúbica, se llama cúbica compacta, y la celda es una estructura hexagonal, se llama hexagonal compacta.
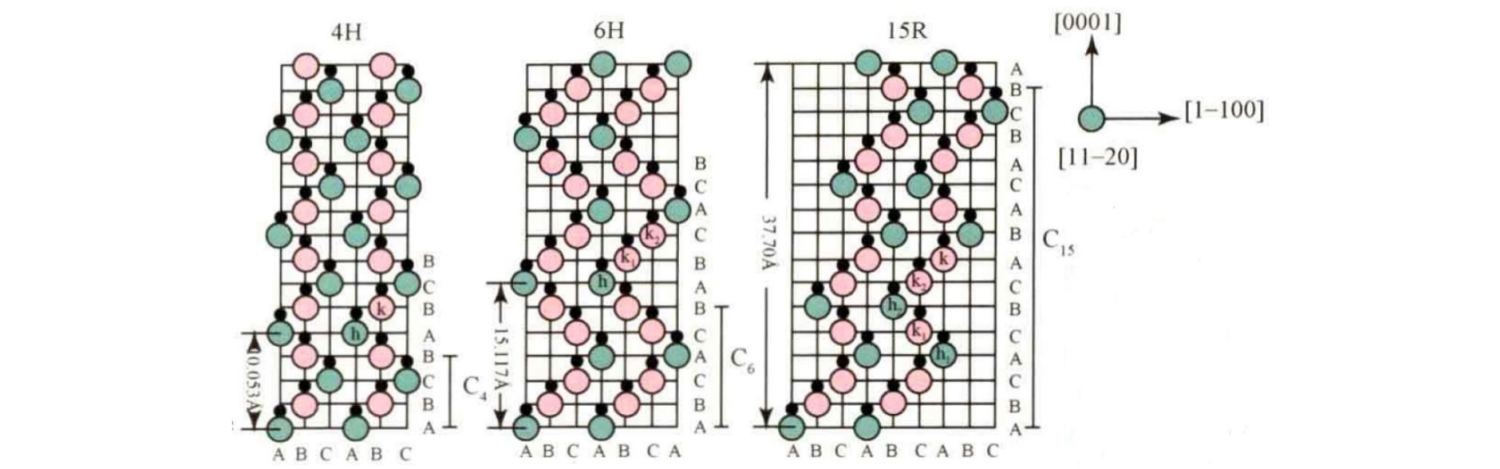
Los tipos de cristales de SiC comunes incluyen 3C-SiC, 4H-SiC, 6H-SiC, 15R-SiC, etc. Su secuencia de apilamiento en la dirección del eje c se muestra en la figura.
Entre ellos, la secuencia de apilamiento básica de 4H-SiC es ABCB...; La secuencia de apilamiento básica de 6H-SiC es ABCACB...; La secuencia de apilamiento básica del 15R-SiC es ABCACBCABACABCB....
Esto puede verse como un ladrillo para construir una casa, algunos de los ladrillos de la casa tienen tres formas de colocarlos, algunos tienen cuatro formas de colocarlos, otros tienen seis formas.
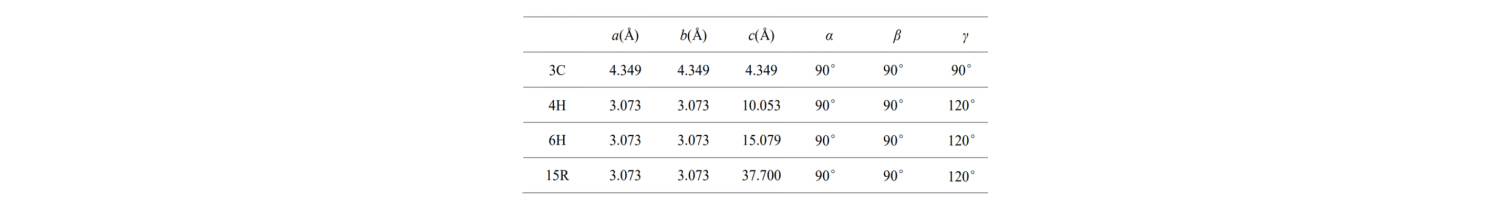
Los parámetros básicos de las celdas de estos tipos de cristales de SiC comunes se muestran en la tabla:
¿Qué significan a, b, c y los ángulos? La estructura de la celda unitaria más pequeña en un semiconductor de SiC se describe a continuación:
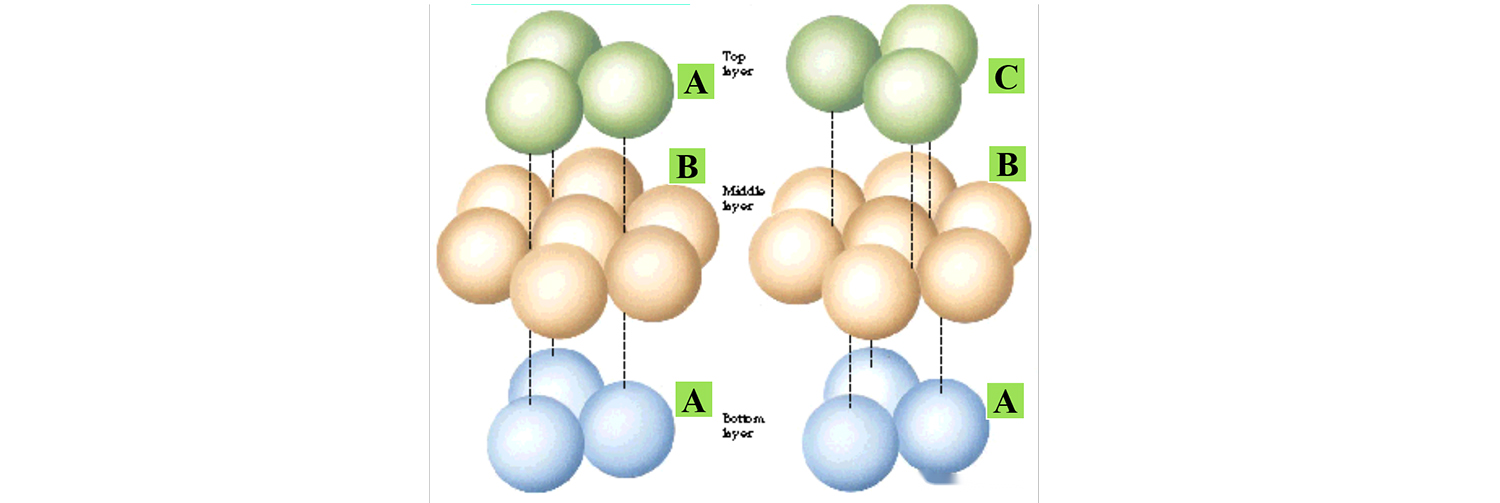
En el caso de la misma celda, la estructura cristalina también será diferente, esto es como si compramos la lotería, el número ganador es 1, 2, 3, compraste 1, 2, 3 tres números, pero si el número está ordenado De lo contrario, la cantidad ganadora es diferente, por lo que el número y el orden del mismo cristal pueden denominarse el mismo cristal.
La siguiente figura muestra los dos modos de apilamiento típicos, solo la diferencia en el modo de apilamiento de los átomos superiores, la estructura cristalina es diferente.
La estructura cristalina formada por SiC está fuertemente relacionada con la temperatura. Bajo la acción de altas temperaturas de 1900~2000 ℃, el 3C-SiC se transformará lentamente en una poliforma de SiC hexagonal como el 6H-SiC debido a su escasa estabilidad estructural. Precisamente debido a la fuerte correlación entre la probabilidad de formación de polimorfos de SiC y la temperatura, y la inestabilidad del propio 3C-SiC, la tasa de crecimiento del 3C-SiC es difícil de mejorar y la preparación es difícil. El sistema hexagonal de 4H-SiC y 6H-SiC son los más comunes y fáciles de preparar, y están ampliamente estudiados por sus características propias.
La longitud del enlace SI-C en el cristal de SiC es de solo 1,89 A, pero la energía de enlace llega a 4,53 eV. Por lo tanto, la diferencia de nivel de energía entre el estado de enlace y el estado de antienlazamiento es muy grande y se puede formar una banda prohibida amplia, que es varias veces mayor que la del Si y el GaAs. El mayor ancho de banda prohibida significa que la estructura cristalina de alta temperatura es estable. La electrónica de potencia asociada puede lograr las características de funcionamiento estable a altas temperaturas y una estructura de disipación de calor simplificada.
La estrecha unión del enlace Si-C hace que la red tenga una alta frecuencia de vibración, es decir, un fonón de alta energía, lo que significa que el cristal de SiC tiene una alta movilidad de electrones saturados y conductividad térmica, y los dispositivos electrónicos de potencia relacionados tienen una Mayor velocidad de conmutación y confiabilidad, lo que reduce el riesgo de falla por sobrecalentamiento del dispositivo. Además, la mayor intensidad del campo de ruptura del SiC le permite alcanzar mayores concentraciones de dopaje y tener una menor resistencia.
En segundo lugar, la historia del desarrollo de los cristales de SiC.
En 1905, el Dr. Henri Moissan descubrió un cristal natural de SiC en el cráter, que parecía un diamante y lo llamó diamante Mosan.
De hecho, ya en 1885, Acheson obtuvo SiC mezclando coque con sílice y calentándolo en un horno eléctrico. En aquella época, la gente lo confundió con una mezcla de diamantes y lo llamó esmeril.
En 1892, Acheson mejoró el proceso de síntesis: mezcló arena de cuarzo, coque, una pequeña cantidad de astillas de madera y NaCl, lo calentó en un horno de arco eléctrico a 2700 ℃ y obtuvo con éxito cristales escamosos de SiC. Este método de sintetizar cristales de SiC se conoce como método Acheson y sigue siendo el método principal para producir abrasivos de SiC en la industria. Debido a la baja pureza de las materias primas sintéticas y al proceso de síntesis aproximado, el método Acheson produce más impurezas de SiC, mala integridad del cristal y diámetro de cristal pequeño, lo que resulta difícil de cumplir con los requisitos de la industria de semiconductores para materiales de gran tamaño, alta pureza y alta -Cristales de calidad, y no se pueden utilizar para fabricar dispositivos electrónicos.
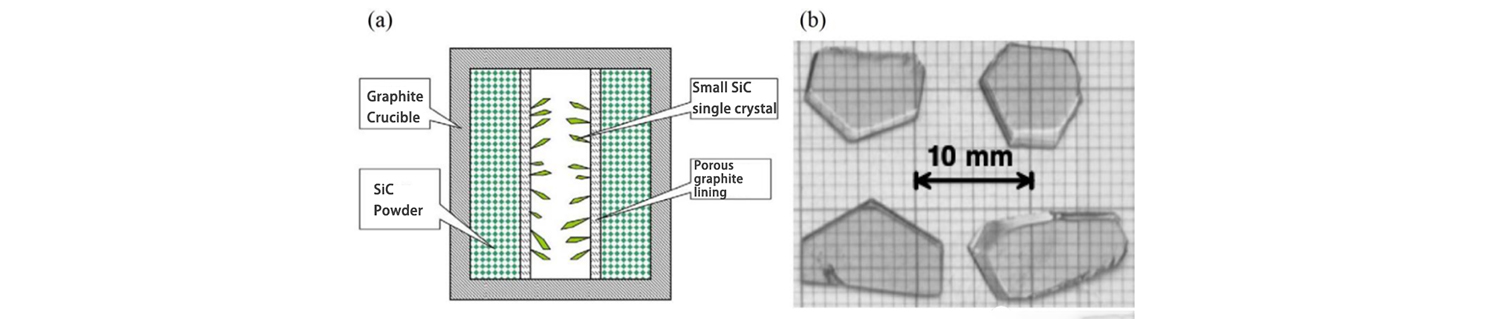
Lely del Laboratorio Philips propuso un nuevo método para cultivar monocristales de SiC en 1955. En este método, se utiliza un crisol de grafito como recipiente de crecimiento, cristal en polvo de SiC se utiliza como materia prima para cultivar cristales de SiC y se utiliza grafito poroso para aislar. un área hueca desde el centro de la materia prima en crecimiento. Durante el crecimiento, el crisol de grafito se calienta a 2500 ℃ bajo una atmósfera de Ar o H2, y el polvo periférico de SiC se sublima y se descompone en sustancias en fase vapor de Si y C, y el cristal de SiC crece en la región hueca media después del gas. El flujo se transmite a través del grafito poroso.
En tercer lugar, tecnología de crecimiento de cristales de SiC.
El crecimiento monocristalino de SiC es difícil debido a sus propias características. Esto se debe principalmente al hecho de que no existe una fase líquida con una relación estequiométrica de Si: C = 1:1 a presión atmosférica, y no puede cultivarse mediante los métodos de crecimiento más maduros utilizados por el actual proceso de crecimiento convencional del semiconductor. industria: método cZ, método de crisol descendente y otros métodos. Según el cálculo teórico, sólo cuando la presión es superior a 10E5atm y la temperatura es superior a 3200 ℃, se puede obtener la relación estequiométrica de la solución Si: C = 1:1. Para superar este problema, los científicos han hecho incansables esfuerzos para proponer varios métodos para obtener cristales de SiC baratos, de gran tamaño y de alta calidad. En la actualidad, los principales métodos son el método PVT, el método en fase líquida y el método de deposición química de vapor a alta temperatura.
Hora de publicación: 24 de enero de 2024